- 您所在位置:新闻动态
Communications Biology|本实验室研究团队揭示可变剪切在马尔尼菲篮状菌免疫逃逸中的作用及机制
作者: 来源:广西艾滋病防治研究重点实验室 发布时间:2023-11-25
2023年10月,广西医科大学艾滋病研究中心梁浩教授团队在Communications Biology(中科院生物学一区)杂志发表题为Talaromyces marneffeisuppresses macrophage inflammation by regulating host alternative splicing的文章。该文章探讨了可变剪切在T.marneffei免疫逃逸中的作用,发现了T. marneffei通过宿主TUT1介导的可变剪切产生截短蛋白NCOR2-013,从而逃避巨噬细胞的杀伤。这一发现不仅为理解T. marneffei-宿主互作的分子机理提供了新视角,也为T. marneffei感染提供了潜在的治疗靶点。

马尔尼菲篮状菌(Talaromyces marneffei, T. marneffei)感染是造成中国南部和东南亚“一带一路”沿线国家艾滋病病人死亡的重要原因,已经成为当地一个严重的公共卫生问题,T. marneffei也被WHO列入“重点真菌病原体清单”[1]。该团队前期研究显示,截至2018年底,T. marneffei病累计病例数为288000 (95% CI:146000–613800),累计死亡数为87900 (95% CI:37200–204300)[2]。T. marneffei的免疫逃逸在T. marneffei病发病机制中扮演着至关重要的角色,也是其不良预后的重要原因之一。目前已知T. marneffei通过多种策略实现免疫逃逸[3-5],然而,可变剪切在T. marneffei免疫逃逸中的作用尚不明确。
研究团队首先通过高通量RNA-seq测序,描绘了T. marneffei感染人THP-1巨噬细胞后的可变剪切景观,并发现了一种在T. marneffei感染后显著上调的截短蛋白NCOR2-013。其次,通过分子机制研究发现NCOR2-013可以与TBL1XR1/TBLR1和HDAC3形成共抑制复合物,进而通过抑制组蛋白乙酰化来抑制JunB介导的促炎细胞因子的转录激活。此外,研究团队鉴定了宿主TUT1作为调节NCOR2-013产生并促进T. marneffei免疫逃逸的可变剪切调节因子。
这些发现表明T. marneffei通过TUT1介导的NCOR2的可变剪切逃避巨噬细胞免疫杀伤,为理解T. marneffei免疫逃逸的分子机制提供了新的视角。
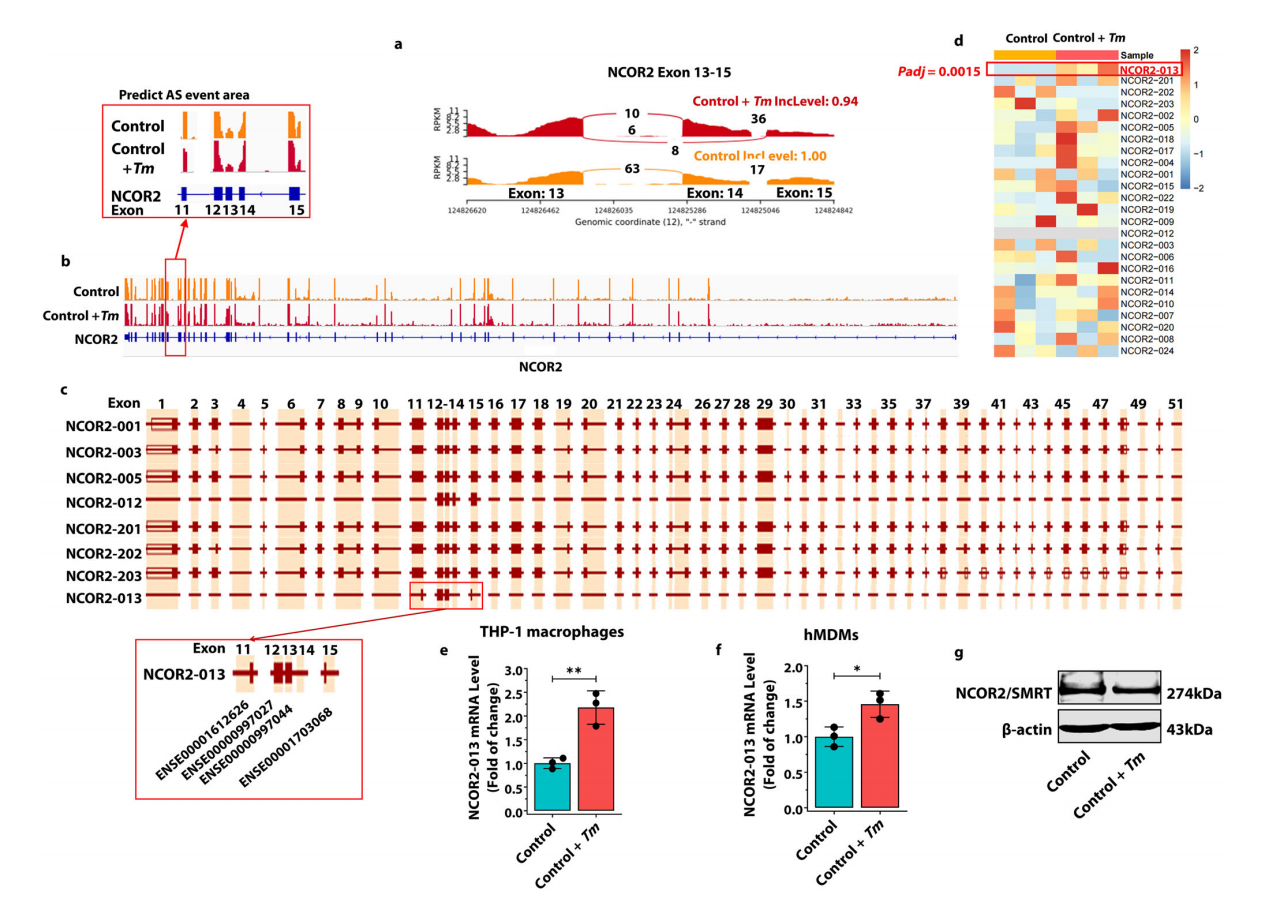
图1 . T. marneffei感染可诱导人巨噬细胞产生NCOR2-013。
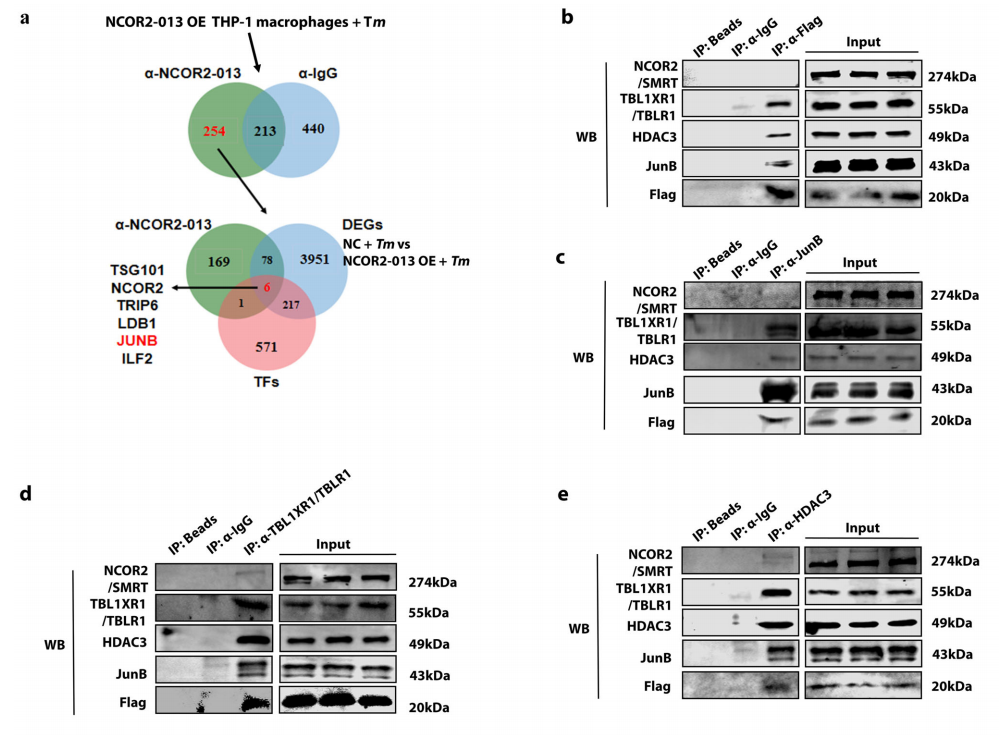
图2. NCOR2-013可以与TBL1XR1/TBLR1和HDAC3形成共抑制复合物。
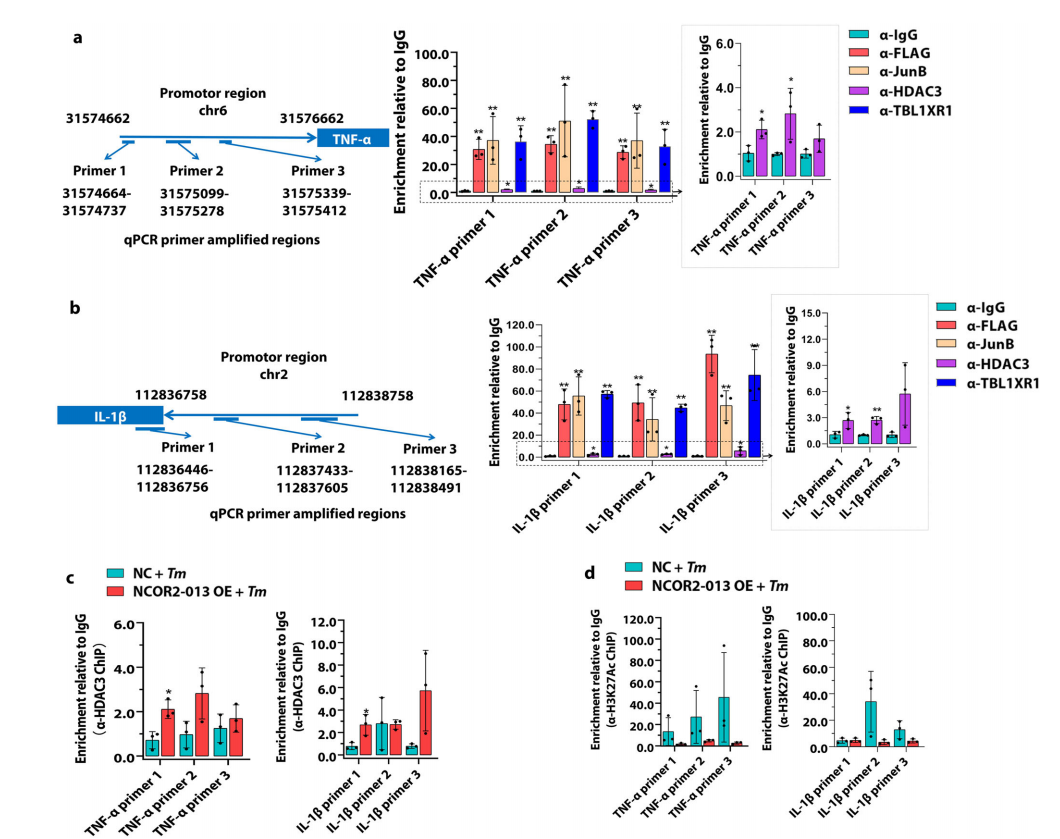
图3. NCOR2-013-TBL1XR1/TBLR1-HDAC3复合物通过抑制组蛋白乙酰化来抑制促炎细胞因子的转录激活。
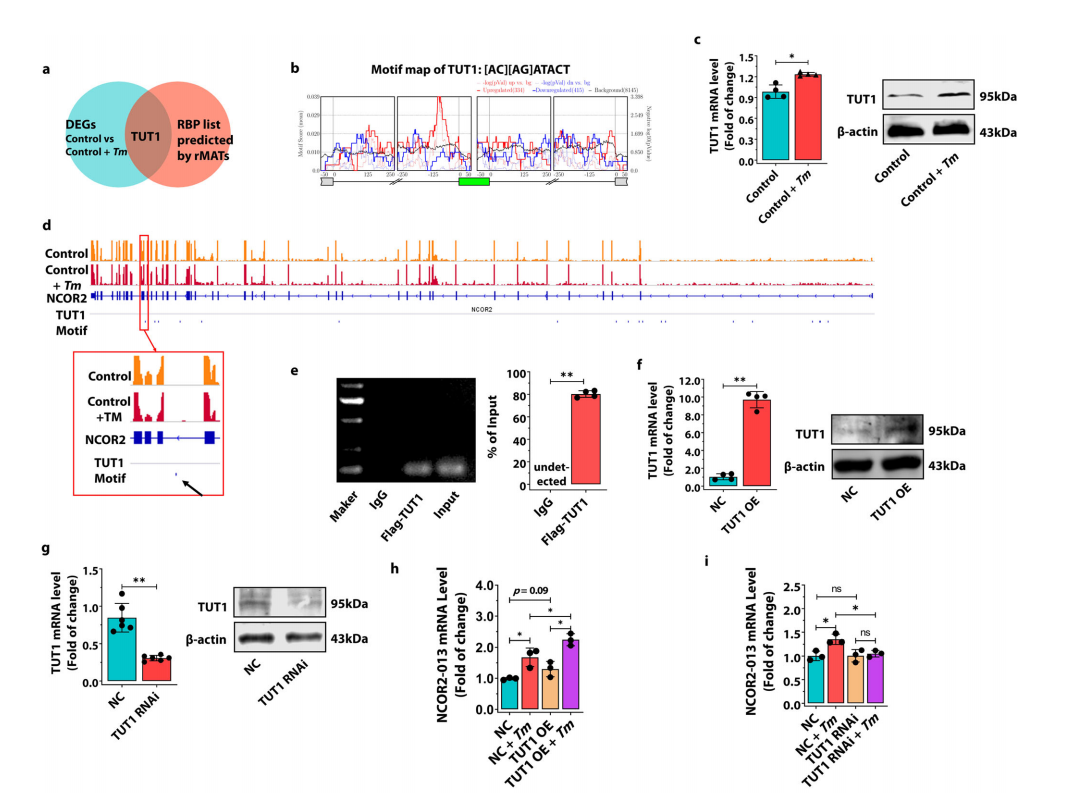
图4.宿主TUT1作为调节NCOR2-013产生的可变剪切调节因子。
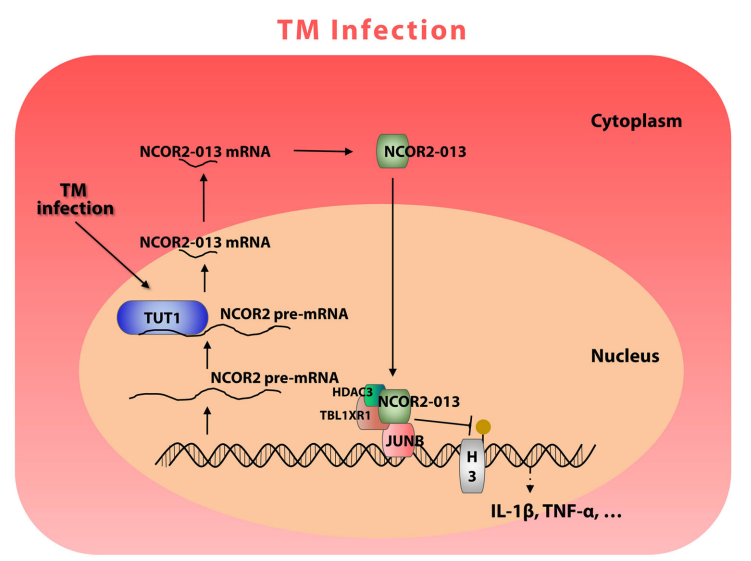
图5.T. marneffei通过宿主TUT1介导的可变剪切产生截短蛋白NCOR2-013,从而巨噬细胞促炎反应。
该论文的第一作者是广西医科大学韦吴迪副研究员,广西医科大学2020级博士研究生王刚、广西医科大学2019级硕士研究生张洪和广西医科大学2021级硕士研究生包秀丽为本文的共同第一作者。广西医科大学蒋俊俊研究员和叶力教授为本文的共同通讯作者,广西医科大学梁浩教授为本文的责任通讯作者。该研究得到广西青年科学基金和国家自然科学基金等课题资助。
参考文献:
[1]WHO fungal priority pathogens list to guide research, development and public health action. Geneva: World Health Organization 2022; Licence: CC BY-NC-SA 3.0 IGO.
[2] Ning C, Wei W, Xu B, et al. The Global Distribution, Drivers, and Burden of Talaromycosis 1964-2017. Boston, MA, USA 2020.
[3] Wei W, Ning C, Huang J, et al. Talaromyces marneffei promotes M2-like polarization of human macrophages by downregulating SOCS3 expression and activating the TLR9 pathway. Virulence 2021; 12(1): 1997-2012.
[4] Wang G, Wei W, Luo Q, et al. The role and mechanisms of PD-L1 in immune evasion during Talaromyces marneffei infection[J]. International Immunopharmacology, 2023, 126: 111255. doi: 10.1016/j.intimp.2023.111255.
[5] Felix E, Vahid P, Luke P, et al. Macrophages protect Talaromyces marneffei conidia from myeloperoxidase-dependent neutrophil fungicidal activity during infection establishment in vivo. Plos Pathogens 2018; 14(6): e1007063.
 学校首页
学校首页



